چکیده (Abstract)
انسدادهای عروقی (Vascular Occlusions) از عوارض نادر اما بالقوه بسیار جدی تزریق فیلرهای پوستی (Dermal Fillers) به شمار میروند که میتوانند پیامدهای مخربی برای بیمار بههمراه داشته باشند. بروز این عارضه و مدیریت صحیح آن، یکی از چالشبرانگیزترین و استرسزاترین شرایط بالینی برای پزشکان فعال در حوزه زیبایی است. مدیریت عوارض (Complications Management) بخش جداییناپذیر از فعالیت حرفهای در این حوزه محسوب میشود و پزشکان باید در شناسایی بهموقع و درمان مؤثر انسدادهای عروقی به سطح بالایی از مهارت، آگاهی و اعتمادبهنفس دست یابند.
با توجه به شیوع نسبتاً پایین انسداد عروقی، آموزش و یادگیری در این زمینه عمدتاً بر پایه دانش تئوریک، مرور منابع علمی و بهاشتراکگذاری تجربیات بالینی در جوامع حرفهای همکار شکل میگیرد. ارائه مراقبت بهینه مستلزم درک صحیح پاتوفیزیولوژی زمینهای (Pathophysiology) و توانایی تشخیص و ارزیابی دقیق علائم بالینی است. پس از تشخیص، آغاز سریع درمان هدفمند (Targeted Therapy) نقش کلیدی در پیشگیری از آسیبهای غیرقابلبرگشت ایفا میکند.
این مقاله با هدف ارائه راهنماییهای کاربردی برای شناسایی و مدیریت انسدادهای عروقی ناشی از تزریق اسید هیالورونیک کراسلینکشده (Cross-linked Hyaluronic Acid) تدوین شده است. همچنین، فرآیند پاتولوژیک ایسکمی بافتی (Tissue Ischemia) بهطور جامع بررسی شده و مراحل قابلتشخیص آن معرفی میشود؛ مراحلی که به تعیین شدت ایسکمی و تخمین بازه زمانی سپریشده از شروع آن کمک میکنند. شناخت این مراحل از اهمیت ویژهای برخوردار است، زیرا مشخص میکند در چه زمانی مداخلات حمایتی جهت ترمیم زخم (Wound Support) ضروری خواهد بود.
مقدمه
انسداد عروقی یکی از عوارض بالقوه شدید تزریق فیلرهای اسید هیالورونیک (Hyaluronic Acid Fillers) است که معمولاً در اثر ورود ناخواسته ماده تزریقی به داخل یک رگ خونی رخ میدهد. از آنجا که فیلرهای اسید هیالورونیک قابلیت تزریق در تمامی لایههای بافتی را دارند، خطر تزریق داخل عروقی ناخواسته (Intravascular Injection) همواره وجود دارد. در صورت عدم تشخیص سریع و مدیریت بهموقع این عارضه، پیامدهایی مانند نکروز بافتی (Tissue Necrosis) ممکن است ایجاد شود و در موارد شدید، خطر بروز نابینایی (Blindness) یا سکته مغزی (Stroke) نیز مطرح خواهد بود.
بر اساس مطالعات حیوانی، شبکیه چشم (Retina) قادر است حدود ۹۷ دقیقه هیپوکسی (Hypoxia) را پیش از ایجاد آسیب غیرقابلبرگشت تحمل کند؛ با این حال، شواهد جدیدتر نشان میدهند که انسداد عروقی میتواند در مدتزمانی بسیار کوتاهتر، حدود ۱۲ تا ۱۵ دقیقه، منجر به انفارکتوس شبکیه (Retinal Infarction) شود.
کاهش ریسک این عارضه مستلزم بهکارگیری تکنیکهای ایمنتر تزریق (Safer Injection Techniques) و تسلط کامل بر آناتومی سهبعدی صورت (Three-dimensional Facial Anatomy) است. افزون بر این، آشنایی با تظاهرات بالینی ایسکمی، وجود پروتکلهای مشخص مدیریتی و مسیرهای ارجاع شفاف (Referral Pathways) برای برخورد با شرایط اورژانسی ضروری است.
شرکت ابزار طب پویا این مقاله را با هدف ارتقای آگاهی پزشکان و کمک به کاهش ریسک انسدادهای عروقی تدوین کرده است. در صورت بروز انسداد عروقی پس از تزریق فیلر، این راهنما میتواند در ارزیابی، تشخیص و مدیریت بالینی وضعیت، با هدف پیشگیری از نکروز بافتی، مورد استفاده قرار گیرد.
علل انسداد عروقی (Causes of Vascular Occlusion)
علاوه بر انسداد مستقیم داخل عروقی ناشی از ورود فیلر اسید هیالورونیک به درون رگ، مکانیسمهای دیگری مانند فشار خارجی (Compression) یا اسپاسم عروقی (Vascular Spasm) نیز میتوانند منجر به بروز تغییرات ایسکمیک در بافت شوند.
ایسکمی و پیامدهای آن بر بافت میتواند خود موجب بروز وازواسپاسم (Vasospasm) گردد. در شرایط ایسکمیک، این اسپاسم معمولاً در اثر کاهش پاسخپذیری عروق به نیتریک اکساید (Nitric Oxide) ایجاد میشود. همزمان، ادم خارجعروقی (Extravascular Edema) میتواند فشار بیشتری بر عروق اطراف وارد کرده و تغییرات بافتی قابلتوجهی ایجاد کند. علاوه بر این، فیلر اسید هیالورونیک در صورت تزریق داخل عروقی میتواند بهعنوان یک محرک مضر (Noxious Stimulus) عمل کرده و التهاب و اسپاسم شدیدتری را القا نماید. این تغییرات ثانویه عروقی، شدت ایسکمی ناشی از انسداد اولیه را تشدید میکنند.
با وجود پیشرفتهای علمی، همچنان نیاز به انجام مطالعات بیشتر برای توصیف دقیق الگوهای عروقی منجر به ایسکمی پس از تزریق فیلر اسید هیالورونیک در نواحی مختلف صورت (Vascular Territories) احساس میشود.
تغییرات ایسکمیک معمولاً بلافاصله یا طی چند ساعت پس از تزریق بروز میکنند. علائم و نشانههای بالینی میتوانند بسیار متغیر باشند و برخورداری از سطح بالای شک بالینی (High Index of Suspicion) برای شناسایی بهموقع آنها اهمیت حیاتی دارد. در موارد نادر، شروع ایسکمی ممکن است با تأخیر و حتی چند روز پس از تزریق ظاهر شود؛ اگرچه مکانیسم دقیق این پدیده هنوز بهطور کامل مشخص نشده است. با این حال، فرضیههای زیر مطرح شدهاند:
وقوع یک رویداد آمبولیک (Embolic Event) در یک آرتریول باریکتر و دورتر از محل تزریق
خاصیت جاذب رطوبت (Hygroscopic Nature) اسید هیالورونیک که میتواند منجر به افزایش حجم بولوس (Bolus) و تشدید انسداد یا فشار خارجعروقی در نواحی مستعد شود
ناکافیبودن حجم بولوس اولیه برای انسداد کامل رگ و بروز انسداد ثانویه در اثر تجمع پلاکتی (Platelet Aggregation)
در مطالعهای توسط تیلور و همکاران (Taylor et al.)، الگوهای ایسکمی مرتبط با شریان افتالمیک (Ophthalmic Artery) و قلمرو آنژیوزومی (Angiosomal Territory) متناظر توصیف شده است. نتایج این مطالعه نشان میدهد که تزریق مستقیم وریدی یا جابهجایی آمبولیهای اسید هیالورونیک از طریق شانتهای شریانی–وریدی (Arteriovenous Shunts) میتواند منجر به الگوهای تأخیری و ترکیبی ایسکمی و نکروز شود. وجود وریدهای بزرگ و بدون دریچه (Avalvular Veins) که دو اربیت را به یکدیگر متصل میکنند و امکان جریان دوطرفه دارند، شریان افتالمیک را در برابر تزریق ناخواسته اسید هیالورونیک آسیبپذیر میسازد.
صرفنظر از علت انسداد یا زمان شروع تغییرات ایسکمیک، پزشک باید تصمیمات درمانی خود را بر اساس تظاهرات بالینی اتخاذ کند؛ ابتدا با هدف بازگرداندن پرفیوژن (Perfusion) و در صورت لزوم، با تمرکز بر حمایت از ترمیم بافتی (Healing Support).
کاهش خطر انسداد عروقی (Mitigating the Risks of Vascular Occlusion)
آناتومی (Anatomy):
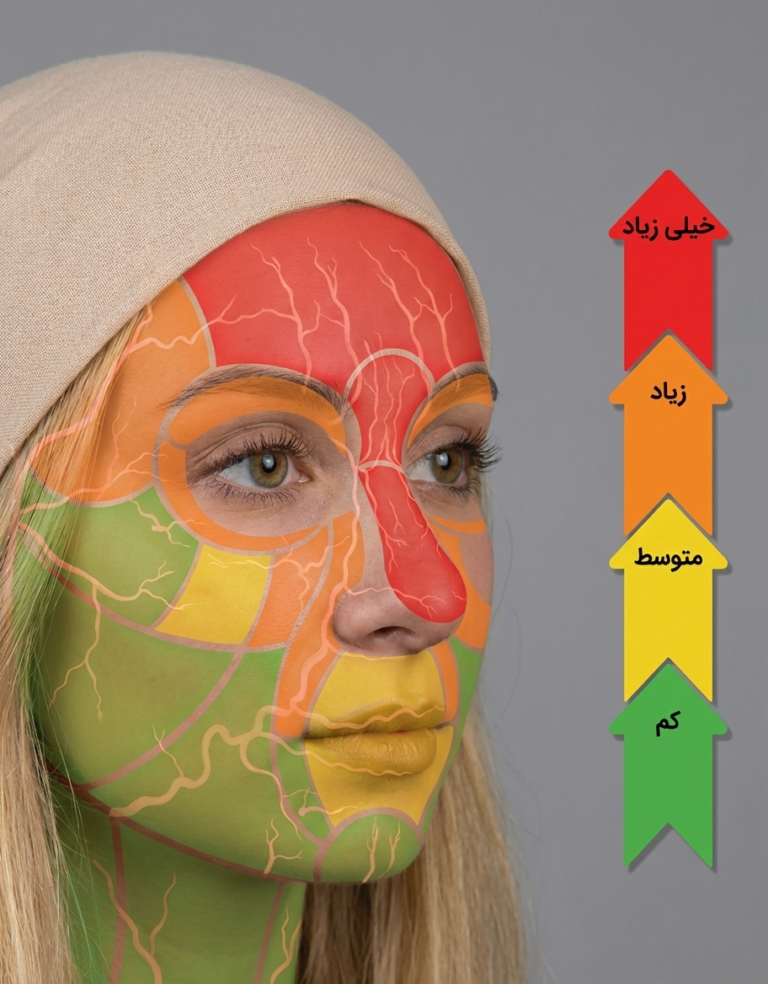
اهمیت درک دقیق آناتومی هرگز نباید دستکم گرفته شود. نواحی هدف برای تزریق فیلرهای بافت نرم (Soft Tissue Fillers) باید بر اساس سطح ریسک طبقهبندی شوند و نباید هیچ ناحیهای بهعنوان «ایمن» توصیف گردد. استفاده از واژه «ایمن» میتواند این تصور نادرست را القا کند که ریسکی وجود ندارد، در حالیکه هر بار عبور سوزن از سد پوستی (Skin Envelope) با مقداری ریسک همراه است. پزشک باید در مرحله برنامهریزی درمان، سطح ریسک هر ناحیه را بهدقت در نظر بگیرد. برای کمک به درک بهتر این موضوع، تصویر زیر صورت را به نواحی با ریسک کم، متوسط، زیاد و بسیار زیاد تقسیمبندی میکند.
| ارزیابی خطر | نواحی تزریق |
|---|---|
| خیلی زیاد | بین ابروها، بینی و پیشانی |
| زیاد | گیجگاه، خطوط گالابلا، ناحیه زیر چشم، اطراف چشم، بخش میانی گونه و کناره بینی |
| متوسط | لبها، ناحیه اطراف دهان و بخش قدامی گونه |
| کم | خط فک، بخشی از گونه، زیرگونه و افزایش حجم چانه |
درک صحیح از عمق (Depth) و الگوی توزیع (Distribution) ساختارهای آناتومیک، نقش کلیدی در کاهش ریسک و افزایش قابلیت پیشبینی نتایج تزریق فیلرهای بافت نرم (Soft-Tissue Fillers) دارد. آناتومی تزریق (Injection Anatomy) به دانشی اطلاق میشود که مستقیماً با محل قرارگیری نوک سوزن (Needle Tip) در لایههای مختلف بافتی (Tissue Layers) ارتباط دارد. این مفهوم از نظر کاربردی با آناتومی جراحی (Surgical Anatomy) و آناتومی رادیوگرافیک (Radiographical Anatomy) متفاوت است.
در منابع استاندارد آناتومی، معمولاً تمرکز بر توزیع ساختارهایی نظیر عروق و اعصاب (Vasculature and Nerves) است که این رویکرد یک آموزش دوبعدی (Two-dimensional Learning Approach) محسوب میشود؛ در حالی که صورت، ساختاری کاملاً سهبعدی (Three-dimensional Structure) دارد. ازاینرو، آموزش مؤثر آناتومی کاربردی در تزریق فیلر مستلزم درک دقیق عمق ساختارها نسبت به پلنهای مختلف بافتی (Tissue Planes) است.
کانولا در برابر سوزن (Cannula versus Needle)
عوارض عروقی (Vascular Complications) میتوانند هم در تزریق با سوزن (Needle) و هم با کانولا (Cannula) رخ دهند. در بسیاری از گزارشهای مرتبط با اختلالات بینایی (Visual Disturbance)، نوع ابزار تزریق بهطور دقیق ذکر نشده است. بررسی دادههای منتشرشده نشان میدهد که تنها در بخشی از موارد، اطلاعاتی درباره استفاده از سوزن یا کانولا ارائه شده و هر دو ابزار با بروز عوارض همراه بودهاند. همچنین مشخص شده است که کانولاهایی با گیج بالا نیز میتوانند با نیرویی مشابه سوزن به داخل شریان (Artery) نفوذ کنند.
در هنگام استفاده از سوزن، این احتمال وجود دارد که سوزن از داخل یک رگ عبور کرده و متعاقب آن، فیلر از طریق مسیر سوزن بهصورت جریان رتروگراد (Retrograde Flow) مجدداً وارد رگ شود.
دادههای جدیدتر نشان میدهند که ایمنی استفاده از کانولا همیشگی نیست. گزارشهایی از آمبولی شدید اسید هیالورونیک شامل موارد نابینایی، سکته مغزی و نکروز وسیع بافتی منتشر شدهاند که در بخش عمدهای از آنها، تزریق با کانولا و نه سوزن انجام شده بود. بر این اساس، توصیه میشود از کانولاهای کوچکتر از گیج ۲۵ استفاده نشود. با این حال، صرفنظر از نوع ابزار تزریق، رعایت کامل اصول و بررسیهای ایمنی (Safety Measures and Checks) الزامی است.
آسپیراسیون (Aspiration)
آسپیراسیون یکی از موضوعات چالشبرانگیز در تزریق فیلر محسوب میشود و نباید بهعنوان تنها ابزار ایمنی مورد اتکا قرار گیرد. شواهد علمی نشان میدهند که قابلیت اطمینان آسپیراسیون محدود بوده و نتایج آن میتواند متغیر باشد.
دقت آسپیراسیون به عواملی نظیر قطر سوزن (Needle Diameter)، مدتزمان اعمال فشار منفی به پیستون (Negative Pressure)، پرایم بودن سوزن (Needle Priming) و طول سوزن (Needle Length) وابسته است. همچنین مشخص شده است که رئولوژی فیلر (Filler Rheology) نقش تعیینکنندهای در دستیابی به یک آسپیراسیون مثبت واقعی (True Positive Aspirate) دارد.
تحلیل دادههای تجمیعی نشان داده است که بین مدول الاستیک فیلر (Elastic Modulus – G’)، کوهسیویته (Cohesivity؛ بر اساس وزن قطره) و سطح مقطع لومن سوزن (Needle Lumen Cross-section) ارتباط وجود دارد؛ با این حال، شواهد کافی برای اثبات ارتباط مستقیم بین نوع محصول، نوع سوزن و حجم پولبک (Pullback Volume) در دسترس نیست.
این یافتهها نشان میدهند که تعیین یک روش آسپیراسیون ایدهآل و یکسان برای تمامی محصولات امکانپذیر نیست. بنابراین، آسپیراسیون منفی (Negative Aspirate) به معنای ایمن بودن تزریق نیست و در صورت مشاهده علائم ایسکمیک (Ischemic Changes)، انسداد عروقی را نمیتوان رد کرد. همچنین باید توجه داشت که برخی تکنیکها مانند نخکشی خطی (Linear Threading) و فنینگ (Fanning) عملاً امکان استفاده مؤثر از آسپیراسیون برای شناسایی کانولاسیون عروقی (Vascular Cannulation) را فراهم نمیکنند.
محصولات (Products)
آگاهی از ویژگیهای محصول تزریقی اهمیت حیاتی دارد. فیلرهای اسید هیالورونیک (Hyaluronic Acid Fillers) از نظر خصوصیات رئولوژیک (Rheological) و فیزیکوشیمیایی (Physicochemical) تفاوتهای قابلتوجهی دارند و این تفاوتها میتوانند بر نحوه و سرعت حلشدن آنها در مواجهه با هیالورونیداز (Hyaluronidase) تأثیرگذار باشند.
مطالعات مقایسهای محدودی درباره میزان حلپذیری برندهای مختلف فیلرهای اسید هیالورونیک در دسترس است و اطلاعات اندکی درباره شیمی اختصاصی بسیاری از این محصولات وجود دارد. شواهد تجربی نشان میدهند که برخی محصولات ممکن است نسبت به تجزیه آنزیمی (Enzymatic Breakdown) مقاومتر باشند؛ با این حال، انجام تحقیقات بیشتر در این حوزه ضروری است.
ارتباط با بیمار (Communication)
برقراری ارتباط مؤثر با بیمار یکی از ارکان اصلی تزریق ایمن محسوب میشود. درد یک تجربه ذهنی (Subjective) است و هرگونه دردی که بیش از حد انتظار باشد باید بلافاصله گزارش شود. احساس ناراحتی خفیف طبیعی است، اما درد شدید در ناحیهای دورتر از محل تزریق (Distal to Injection Site) یا بروز تغییرات حسی (Alterations in Sensation) طبیعی تلقی نمیشود.
اصول عملکرد صحیح (Good Practice)
با ارتقای دانش آناتومی تزریق (Injection Anatomy) و بهکارگیری تکنیکهای ایمنتر (Safer Techniques)، میتوان هم احتمال بروز انسداد عروقی و هم شدت عوارض ناشی از آن را بهطور قابلتوجهی کاهش داد.
دستورالعمل اقدامات صحیح در تزریق
آشنایی با آناتومی ناحیه تزریق:
آگاهی دقیق از عمق، مسیر و واریاسیونهای شایع عروقی برای انتخاب ایمنترین لایه تزریق ضروری است. در بیماران دارای سابقه جراحی صورت، تزریق باید با احتیاط بیشتری انجام شود، زیرا جراحی میتواند آناتومی طبیعی را تغییر داده باشد. همچنین در نواحی دارای اسکار یا سابقه جراحی، دقت بیشتری مورد نیاز است.
تکنیک:
تزریق باید آهسته و با حداقل فشار انجام شود تا خطر ورود ناخواسته فیلر به داخل رگ، جریان رتروگراد (Retrograde Flow) و وسعت ایسکمی کاهش یابد. استفاده از کانولا با گیج ۲۵ یا بزرگتر قابلتأمل است. تزریق در هر نقطه باید با حجمهای کوچک انجام شود تا اندازه بالقوه انسداد کاهش یابد. در صورت انجام آسپیراسیون، باید به محدودیتهای این روش آگاه بود. استفاده از فشار دیجیتال هدفمند میتواند به فشردن مسیرهای شریانی و کاهش حرکت رتروگراد فیلر کمک کند. همچنین توصیه میشود از لیدوکائین حاوی آدرنالین استفاده نشود، زیرا میتواند رنگپریدگی ناشی از انسداد را پنهان کند.
مشاهده و پایش:
تغییرات رنگ پوست باید بهدقت بررسی شوند و از بیمار خواسته شود هرگونه احساس غیرطبیعی مانند درد یا اختلالات بینایی را فوراً گزارش کند.
ارزیابی انسداد عروقی مشکوک (Assessing a Suspected Vascular Occlusion)
انسدادهای عروقی ممکن است بلافاصله پس از تزریق بروز کنند یا با تأخیر و حتی چند ساعت تا چند روز بعد تظاهر یابند. توانایی ارزیابی صحیح زمان بازگشت مویرگی (Capillary Refill Time – CRT) اهمیت بالایی دارد، زیرا امکان شناسایی سریع ایسکمی بافتی (Tissue Ischemia) و تخمین وسعت ناحیه درگیر را فراهم میکند.
ارزیابی CRT:
ارزیابی CRT در امتداد مسیر توزیع شریان بلافاصله پس از تزریق ضروری است. پس از تزریق در نواحی پرخطر مانند بینی، گلابلا یا پیشانی، توصیه میشود بیمار به مدت ۳۰ تا ۴۵ دقیقه تحت پایش قرار گیرد. CRT که نشاندهنده مدتزمان بازگشت خون پس از اعمال فشار است، باید در هر دو سمت ناحیه متناظر صورت بررسی شود. CRT کمتر از دو ثانیه طبیعی تلقی میشود، در حالی که بازگشت سریع یا بیشازحد (Brisk CRT) میتواند نشاندهنده نارسایی وریدی (Venous Insufficiency) باشد.
درد (Pain):
مقداری ناراحتی حین تزریق طبیعی است، اما درد ناگهانی و پیشرونده چه در محل تزریق و چه در ناحیهای دورتر، غیرطبیعی محسوب میشود و باید منجر به توقف فوری تزریق و ارزیابی بافت شود. همچنین در صورت تشدید درد پس از تزریق، بیمار باید بدون تأخیر مجدداً ویزیت شود. لازم به ذکر است که در مراحل اولیه انسداد عروقی، درد ممکن است وجود نداشته باشد.
رنگ پوست (Skin Color):
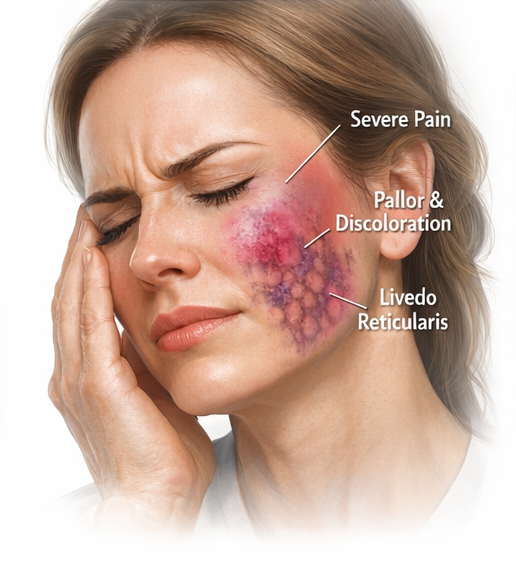
تغییرات رنگ پوست یکی از شاخصهای مهم ایسکمی بافتی است. این تغییرات میتوانند در مراحل مختلفی بروز کنند و در پیشبینی احتمال بهبود یا تخریب بافتی نقش داشته باشند. پس از کاهش یا قطع خونرسانی، بافت ممکن است رنگپریده یا تیره و کدر به نظر برسد. این حالت ممکن است گذرا باشد، اما بهتدریج میتواند به الگوی بنفش شبکهای (Reticulated Purple Pattern) ناشی از تجمع خون بدون اکسیژن تبدیل شود.
ارزیابی کامل صورت، بهویژه در امتداد مسیر شریانها و عروق ارتباطی (Communicating Vessels)، اهمیت بالایی دارد؛ زیرا فیلر میتواند به شاخههای دورتر سیستم عروقی مهاجرت کند. مشاهده هرگونه رنگپریدگی، تیرگی یا پیشرفت این تغییرات، نیازمند مداخله و درمان فوری کل ناحیه درگیر است.
تغییرات ایسکمیک پوستی، از جمله رنگپریدگی (Pallor) و ایجاد الگوی رتیکوله (Reticulation)، الزاماً به معنای وقوع حتمی نکروز (Necrosis) نیستند. ظرفیت تحمل ایسکمی در بافتهای مختلف متفاوت است و این تفاوت به نوع بافت (Tissue Type) بستگی دارد. شدت آسیب بافتی تابعی از دو عامل اصلی، یعنی میزان شدت (Magnitude) و مدتزمان (Duration) ایسکمی است. در مواردی که تنها رنگپریدگی یا یک الگوی رتیکوله خفیف مشاهده میشود، در صورت بازگرداندن سریع جریان خون (Re-establishing Blood Flow)، معمولاً آسیب بافتی حداقلی خواهد بود.
نکروز به مرگ سلولی (Cell Death) اطلاق میشود و نشاندهنده از دست رفتن حیات و قابلیت ترمیم بافت (Loss of Viability) است. از این رو، ضایعات نکروتیک در عمل بهعنوان زخم (Wound) در نظر گرفته میشوند. در مواردی که تغییرات ایسکمیک ناشی از انسداد شریانی (Arterial Occlusion) با تأخیر تشخیص داده شوند—برای مثال چند روز پس از تزریق—تصویر بالینی میتواند پیچیده باشد. در چنین شرایطی، ممکن است مراحل مختلف ایسکمی و درجات متفاوتی از آسیب بافتی بهطور همزمان در یک ناحیه مشاهده شوند. برخی بخشها ممکن است بهسرعت بهبود یابند یا تنها به حداقل مداخلات حمایتی نیاز داشته باشند (مراحل ۱، ۲ و ۳)، در حالی که در نواحی دیگر، نکروز پایدارتر و تثبیتشدهتری وجود دارد (مراحل ۴ و ۵).
بر اساس توصیههای تخصصی، حتی در صورت وجود نواحی با نکروز تثبیتشده، تلاش برای حل کردن آمبولی اسید هیالورونیک (Hyaluronic Acid Embolus) در رگ مسدودشده همچنان ضروری تلقی میشود، زیرا این اقدام میتواند از گسترش بیشتر آسیب جلوگیری کند.
در صورتی که انسداد شریانی بدون درمان باقی بماند، بافت بهتدریج مراحل مختلف ایسکمی را طی خواهد کرد. وسعت و شدت آسیب بافتی به عوامل متعددی وابسته است، از جمله اندازه انسداد، ویژگیهای آناتومیک زمینهای (Underlying Anatomy)، میزان خونرسانی جانبی (Collateral Supply)، سلامت کلی سیستم عروقی (General Vascular Integrity)، توانایی ترمیم بافت و همچنین وجود یا عدم وجود عفونت.
ارزیابی مراحل انسداد عروقی (Assessing the Stages of a Vascular Occlusion)
یک رویکرد مبتنی بر ارزیابی بالینی پوست (Skin Assessment Strategy) برای تعیین وسعت درگیری و شناسایی مرحله تغییرات ایسکمیک توصیه میشود. درک مکانیسمهای پاتولوژیک زمینهای که منجر به بروز تغییرات پوستی میشوند، به همان اندازه اهمیت دارد که توانایی تشخیص و افتراق مراحل مختلف ایسکمی. در مواردی که تخریب بافتی رخ داده و زخم ایجاد شده است، پس از رفع انسداد عروقی، اجرای برنامههای اختصاصی مدیریت زخم (Specific Wound Management) ضروری خواهد بود.
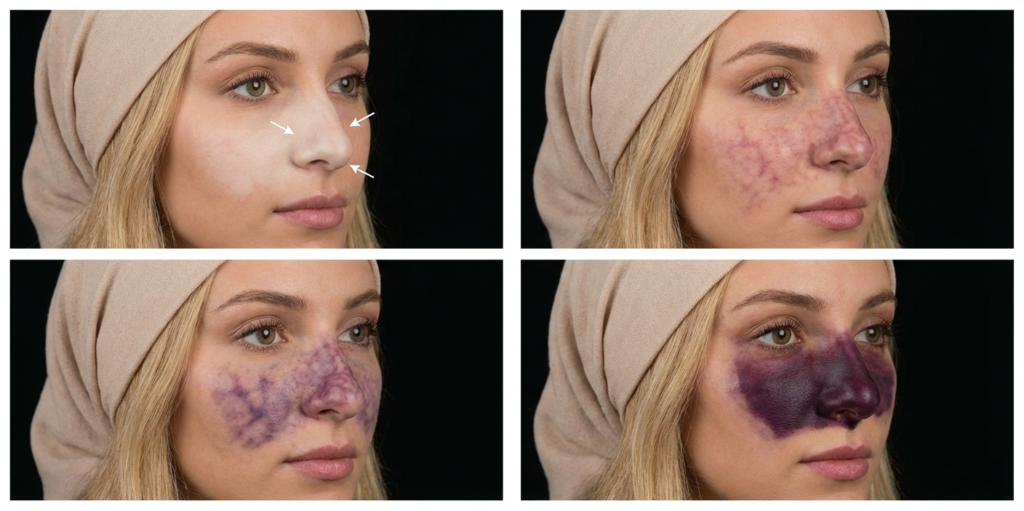
بهطور کلی، تغییرات پوستی ناشی از انسداد شریانی از یک سیر نسبتاً قابل پیشبینی پیروی میکنند و میتوان آنها را در قالب پنج مرحله مجزا (Stages 1–5) طبقهبندی کرد؛ طبقهبندیای که نقش مهمی در تصمیمگیری درمانی و پیشبینی پیامدهای بالینی ایفا میکند.
| مراحل پوستی انسداد | پاتوفیزیولوژی | شروع و مدت زمان معمول |
|---|---|---|
| مرحله ۱: رنگپریدگی (Pallor) | انسداد فوری آرتریول که باعث توقف ناگهانی جریان خون و پرفیوژن بافتی میشود | بلافاصله، چند ثانیه طول میکشد یا ممکن است پایدار بماند |
| مرحله ۲: لیوِدو رتیکولاریس (Livedo reticularis) | تجمع خون بدون اکسیژن در شبکه وریدی اطراف | میتواند سریع ظاهر شود و ۲۴ تا ۳۶ ساعت باقی بماند |
| مرحله ۳: پُستولها (Pustules) | کاهش pH، کاهش تعریق و تغییرات متابولیک که اجازه رشد بیشازحد Staphylococcus aureus را بهعنوان یک هوازی اختیاری میدهد | حدود ۷۲ ساعت |
| مرحله ۴: انعقاد (Coagulation) (ممکن است قبل از مرحله ۳، همزمان با آن یا زیر پُستولها رخ دهد. این مرحله نشاندهنده شروع نکروز است.) | بافت به دلیل هیپوکسی شدید سیاه میشود. لیز سلولی و خروج خون به بافتها رخ میدهد. بافت سفت است و معماری آن به دلیل نکروز انعقادی حفظ میشود | طی چند روز |
| مرحله ۵: بافت غیرزنده (Devitalised tissue) | تخریب بافت و تجمع پروتئینهای ساختاری دناتورهشده (کلاژن، فیبرین، الاستین)، نوتروفیلها، باکتریها و هموگلوبین. اسلاو مرطوب و به رنگ زرد کرمی یا سبز است. اسکار سیاه (تیره) و خشک است | طی چند روز |
رنگپریدگی (Pallor) و متعاقب آن لیودو رتیکولاریس (Livedo Reticularis) پدیدههای شایعی هستند که به اختلال جریان شریانی (Arterial Compromise) نسبت داده میشوند. بروز لیودو رتیکولاریس به دلیل آناتومی و فیزیولوژی سیستم میکروواسکولار پوست (Cutaneous Microvascular System) ظاهر نسبتاً تیپیکی دارد.
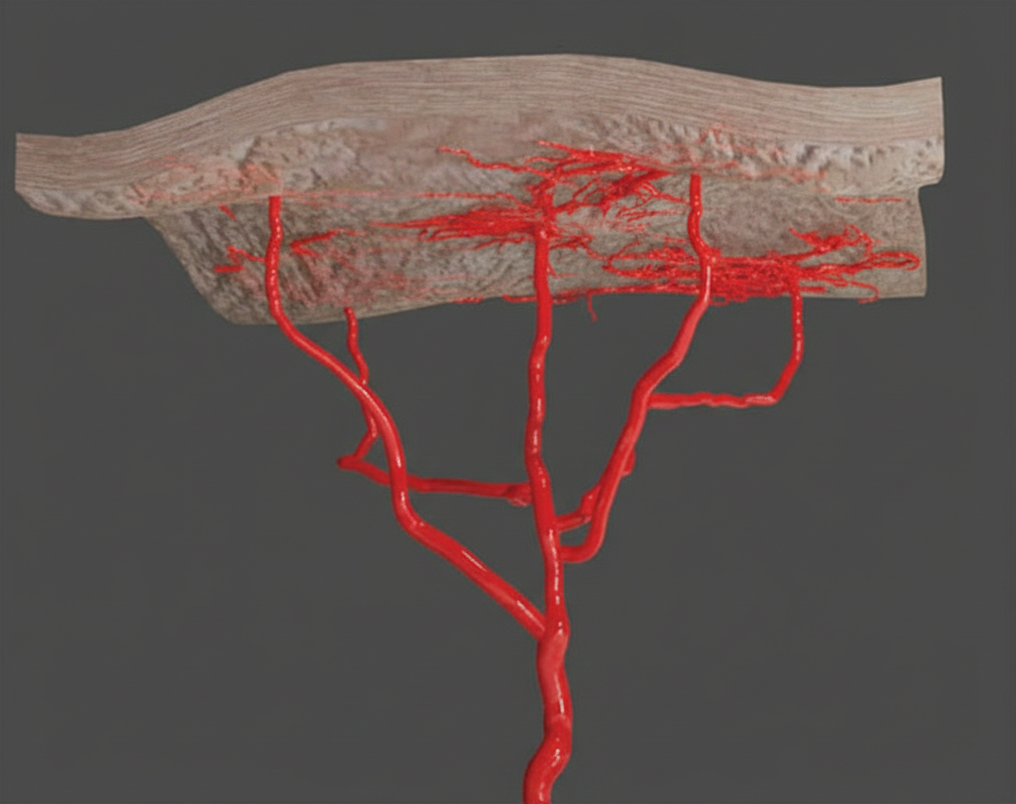
جریان شریانی پوست از تعداد زیادی آرتریول صعودی (Ascending Arterioles) تشکیل شده که به صورت عمود بر سطح پوست بالا آمده و با تقسیم شدن، شبکهای از مویرگها (Capillary Bed) را در سطح پوست ایجاد میکنند. شریان مرکزی (Central Artery) پوست را با الگویی شبیه شاخههای درخت (Tree-like Pattern) خونرسانی میکند. انسداد آرتریول یا شریان موجب توقف یا محدود شدن جریان خون (Blood Flow) شده و در نتیجه بافت دچار بلانچینگ (Blanching) و رنگپریدگی میشود.
با گذشت زمان، نمای بالینی پوست به سمت الگویی لکهلکه و مرمری (Mottled Appearance) تغییر میکند که به آن لیودو رتیکولاریس گفته میشود. در زیرواحدهای عروقی (Vascular Subunit)، شبکههای مویرگی توسط پلکسوس وریدی محیطی که آرتریول مرکزی را احاطه کرده است، خون بدون اکسیژن (Deoxygenated Blood) را تخلیه میکنند. هر عاملی که موجب افزایش نمایان شدن شبکه وریدی شود—مانند احتقان ناشی از هیپوکسی پوستی (Skin Hypoxia)—منجر به ظهور بالینی لیودو رتیکولاریس میشود.
با پیشرفت انفارکتوس بافتی (Tissue Infarction)، پوست ممکن است به تدریج تهرنگ خاکستری (Gray Hue) به خود بگیرد. لیودو رتیکولاریس اغلب به صورت لکههای بنفشرنگ (Purple Mottling) روی پوست دیده میشود و ظاهر آن به میزان پیگمانتاسیون بافتی (Tissue Pigmentation) بستگی دارد. تشخیص علائم هیپوکسی در پوستهای تیره اهمیت ویژهای دارد، زیرا نمای بالینی ممکن است متفاوت باشد.
مراحل ۳ و ۴ (Stages 3 and 4) ممکن است از نظر توالی زمانی جابهجا ظاهر شوند، اما هر دو نشاندهنده شروع و پیشرفت نکروز بافتی (Tissue Necrosis) هستند. مرحله پوستولی (Pustular Stage) معمولاً در حدود روز سوم (Day 3) مشاهده میشود. در طی ایسکمی (Ischemia)، متابولیسم بیهوازی (Anaerobic Metabolism) غالب شده و عملکرد غدد عرق (Sweat Glands) مختل میشود. کاهش تولید عرق موجب افزایش pH سطح پوست و کاهش میزان نمک (Salt) میگردد که شرایط رشد بیشازحد باکتریها (Bacterial Overgrowth) را فراهم میکند.
باکتریهای فلور طبیعی پوست به لایههای عمقیتر درم (Dermis) نفوذ میکنند، محیطی گرم، مرطوب و کماکسیژن که شرایط مناسبی برای تکثیر آنها ایجاد میکند. استافیلوکوکها (Staphylococcus) که بخشی از فلور طبیعی پوست هستند، در این محیط میتوانند به راحتی رشد کنند و علت اصلی رشد بیشازحد باکتریایی محسوب میشوند.
تیرهتر شدن بافت و سیاهشدگی ناحیه ایسکمیک ناشی از نکروز هموراژیک پوست (Hemorrhagic Skin Necrosis) است که بیانگر انسداد ترومبوتیک (Thrombotic Occlusion) یک یا چند رگ پوست است. در این حالت، عروق آسیبدیده دچار نشت گلبولهای قرمز (Red Blood Cells) به بافتهای اطراف شده و این سلولها در بافت در حال مرگ به دام میافتند. دئوکسیژنه شدن هموگلوبین (Deoxygenation of Hemoglobin) موجب ایجاد رنگ سیاه میشود. سلولهای در حال مرگ، سایتوکاینهای پیشالتهابی (Pro-inflammatory Cytokines) آزاد میکنند و در مرز ناحیه نکروتیک، عروق دچار اتساع (Vasodilation) و هیپرمیا (Hyperemia) میشوند، که رنگ خاکستری–قرمز تیره (Dusky Gray-red Color) در پوست اطراف ایجاد میکند.
برخی آسیبهای ایسکمیک دیررس (Late Ischemic Insults) پیش از هرگونه تخریب واضح بافتی به صورت نواحی بسیار تیره پوست ظاهر میشوند. حتی پس از تجویز هیالورونیداز (Hyaluronidase)، بافت در مراحل ۳ یا ۴ ممکن است دچار تخریب شود، زیرا آسیب قبلاً رخ داده است. نکروز همراه با حفظ معماری بافتی (Retained Tissue Architecture) با عنوان نکروز انعقادی (Coagulative Necrosis) شناخته میشود، که در آن آنزیمهای تجزیهکننده سلولها به دلیل آسیب هیپوکسیک غیرفعال میشوند. بافت سفت، ممکن است کوچکشده یا متورم به نظر برسد، در حالی که معماری آن حفظ شده است. هضم سلولی عمدتاً به وسیله هترولیز (Heterolysis) انجام میشود و این امر تأخیر در تجزیه بافت نکروتیک را توضیح میدهد.
اِسکار (Eschar) به بافت غیرقابل حیات (Devitalized Tissue) گفته میشود که از خون خشکشده، ترشحات (Exudate) و پروتئینهای دناتورهشده (Denatured Proteins) شامل کلاژن، الاستین، فیبرین و هموگلوبین تشکیل شده است. وجود اسکار روی زخم روند ترمیم را مختل کرده و محیط ایدهآلی برای رشد باکتریها ایجاد میکند. پیش از تشکیل اسکار یا به جای آن، اسلاف (Slough) مشاهده میشود که بافت غیرقابل حیات است، اما میزان رطوبت آن متفاوت است و میتواند کرمی، زرد–سبز، ژلاتینی یا رشتهای دیده شود. اسلاف سبزرنگ (Green Slough) شاخصی از عفونت است. مدیریت مناسب زخم شامل جلوگیری از عفونت و تسهیل ترمیم بهینه است.
آسیب ناشی از بازپرفیوژن (Reperfusion Injury)
آسیب بافتی صرفاً محدود به مرحله ایسکمی نیست. بازپرفیوژن (Re-establishment of Vascular Supply) باعث ورود اکسیژن و فعال شدن واکنشهای آنزیمی میشود که تولید سوپراکسید (Superoxide)، پراکسید هیدروژن (Hydrogen Peroxide) و رادیکالهای آزاد هیدروکسیل (Hydroxyl Free Radicals) را در پی دارد. این رادیکالها موجب آسیب سلولهای اندوتلیال (Endothelial Cells)، کاهش نیتریک اکساید (NO)، اختلال در کشتار باکتریایی وابسته به نوتروفیلها و تجمع نوتروفیلها میشوند. لکوسیتها به دیواره اندوتلیال میچسبند و باعث وازوکانستریکشن و جریان پایین خون (Low-flow State) میشوند، که نهایتاً منجر به ترومبوز داخل عروقی (Intravascular Thrombosis) میشود. مداخله درمانی در این شرایط بسیار وابسته به زمان است و ایسکمی طولانیمدت آسیب بازپرفیوژنی شدیدتری ایجاد میکند.
اکسیژندرمانی پرفشار (Hyperbaric Oxygen Therapy – HBOT)
HBOT در مدیریت انسدادهای عروقی ناشی از فیلر و برخی موارد نابینایی مطرح میشود، اما سطح شواهد علمی برای اثربخشی آن محدود است. گزارشهای موردی اثر مثبت HBOT در برخی انسدادهای شریانی و وریدی پوست و اختلال بینایی ناشی از ایسکمی نشان دادهاند. با این حال، دادههای مقایسهای مستقیم و زمان بهینه برای اجرای HBOT هنوز مشخص نیستند.
درمان انسداد عروقی ناشی از هیالورونیک اسید کراسلینکشده
درک زیرواحدهای عروقی (Vascular Subunits) و نحوه اتصال آنها به یکدیگر، و اینکه الگوی تغییرات ایسکمیک چگونه محل تزریق هیالورونیداز را تعیین میکند، ضروری است. بدن از قلمروهای عروقی به نام آنژیوزوم (Angiosomes) تشکیل شده است که هر کدام ناحیهای مشخص را خونرسانی میکنند. برخی نواحی توسط یک آرتریول پرفوراتور منفرد تغذیه میشوند، در حالی که دیگر نواحی توسط یک پرفوراتور که چند قلمرو عروقی را از طریق آناستوموزهای واقعی یا عروق چوک متصل میکند، خونرسانی میشوند. آناستوموزهای واقعی جریان پایدار را حفظ میکنند، در حالی که عروق چوک کمفشار میتوانند برای جلوگیری از عبور مواد مضر دچار کلاپس شوند.
انسداد عروقی ناشی از تزریق اسید هیالورونیک
تزریق اسید هیالورونیک (Hyaluronic Acid – HA) به داخل شریان اصلی یا شاخههای پرفوراتور آن میتواند موجب اسپاسم عروقی (Vessel Spasm) در کل ناحیه آنژیوزومی (Angiosomal Region) شود. این اتفاق به دلیل فروپاشی اتصالات آناستوموتیک نوع چوک (Choke Anastomotic Connections) رخ میدهد. اسید هیالورونیک بهعنوان محرک مضر (Noxious Stimulus) میتواند منجر به انسداد عروق چوک شود، که این پدیده به ایسکمی در نواحی دیستال نسبت به محل تزریق کمک میکند. جریان آشفته (Turbulent Flow) در عروق ممکن است HA را قطعهقطعه کند و انسدادهای ثانویه ایجاد کند، بنابراین درمان کل ناحیه ایسکمیک ضروری است.
تشکیل ترومبوز (Thrombus Formation) در مراحل اولیه پس از تزریق داخلشریانی HA مشاهده شده و مداخله سریع برای جلوگیری از تجمع ترومبوز قرمز (Red Thrombus Accumulation) ضروری است. داروهای ضدپلاکت (Antiplatelets) قادر به حل ترومبوز تثبیتشده نیستند و تنها از تجمع پلاکت جلوگیری میکنند.
مدیریت فوری انسداد عروقی
توقف تزریق:
-
هرگاه انسداد عروقی مشکوک باشد، تزریق باید بلافاصله متوقف شود.
-
بیمار باید از وضعیت آگاه شود و حفظ آرامش اهمیت دارد.
-
در صورت عدم اطمینان پزشک، از همکار باتجربه کمک گرفته شود.
ارزیابی زمان پرشدگی مویرگی (CRT):
-
CRT در ناحیه آسیبدیده و ناحیه سالم اندازهگیری شود.
-
CRT طولانی، نشاندهنده اختلال شریانی است. CRT سریع در پوست کبود، میتواند اختلال وریدی را نشان دهد.
-
CRT پیش از درمان ثبت شود تا حالت پایه مشخص باشد و امکان مقایسه وجود داشته باشد.
نشانههای پوستی و علامتگذاری:
-
پوست ناحیه در نور مناسب بررسی و فیلمبرداری شود.
-
کل ناحیه ایسکمیک علامتگذاری شود.
هیالورونیداز (Hyaluronidase):
-
۱۵۰۰ واحد هیالورونیداز با ۱ میلیلیتر محلول 0.9٪ سدیم کلراید باکتریواستاتیک یا لیدوکائین ۱–۲٪ رقیق شود.
-
تزریق در امتداد مسیر شریان درگیر و کل ناحیه ایسکمیک انجام شود.
-
در صورت گستردگی ناحیه، ممکن است بیش از یک ویال مورد نیاز باشد.
-
پوشش کامل ناحیه مهمتر از تعداد واحدهای مصرفی است.
-
گرما و ماساژ اعمال شود تا تجزیه مکانیکی HA تسهیل گردد.
-
CRT پس از تزریق دوباره بررسی و با فیلم اولیه مقایسه شود.
-
در صورت باقی ماندن CRT طولانی، تزریق تکرار شود.
نکات مهم:
-
نیازی به تزریق مستقیم هیالورونیداز به داخل شریان نیست؛ آنزیم از تزریق خارج عروقی وارد شریان میشود.
-
هیالورونیداز میتواند با لیدوکائین ۱–۲٪ بازسازی شود که Vasodilation جزئی ایجاد میکند.
-
تست حساسیت (Skin Test) در شرایط انسداد عروقی توصیه نمیشود، اما داروهای اضطراری مانند آدرنالین باید در دسترس باشند.
-
استفاده از مدل دوز پالس با دوز بالا (High-dose Pulsed Dosing) توصیه میشود.
مدیریت با سونوگرافی
-
سونوگرافی فرکانس بالا برای شناسایی دقیق محل، عمق و اندازه آمبولی HA مفید است.
-
مطالعات نشان دادهاند با ۳۵ تا ۶۰ واحد هیالورونیداز، آمبولی به طور مؤثر حل میشود؛ در موارد محدود تا ۱۵۰ واحد ممکن است نیاز باشد.
مدیریت دارویی تکمیلی
-
آسپیرین: بر اساس شواهد ACS، میتوان ۳۰۰ میلیگرم دوز استات و سپس ۷۵ میلیگرم روزانه تجویز کرد. در صورت حساسیت به آسپیرین، کلوبیدوگرل جایگزین است.
-
پماد نیتروگلیسیرین و HBOT: شواهد قوی برای انسداد ناشی از HA ندارند، اما در انسدادهای ناشی از پرکنندههای ذرهای توصیه میشوند.
-
استروئیدها و سیلدنافیل معمولاً توصیه نمیشوند، مگر در شرایط خاص بالینی.
مراقبت از زخم و پیگیری
-
در صورت بروز آسیب بافتی، جلوگیری از عفونت و حمایت از ترمیم ضروری است.
-
ممکن است دبریدمان، داروهای موضعی یا آنتیبیوتیک نیاز باشد، اما مصرف روتین آنتیبیوتیک توصیه نمیشود.
-
ثبت تصاویر و یادداشتبرداری همزمان توصیه میشود.
-
بیماران باید از علائم هشداردهنده انسداد و شماره تماس اضطراری مطلع شوند.
-
بررسی فوری حضوری در صورت شک به انسداد ضروری است.
-
انسدادهای درمانشده سریع نیز نیاز به پیگیری روز بعد دارند.
-
موارد شدیدتر که باعث آسیب پوستی شدهاند، باید تا زمان بهبودی کامل پیگیری شوند.

